近日,由我校药学院许康教授、检验学院王春莉副教授团队联合武汉协和医院董念国教授等国内多家单位,在心血管领域全球排名前2的顶级期刊European Heart Journal(最新IF:37.6,中科院1区,医学顶级期刊)上发表创新研究成果。湖北时珍实验室、湖北中医药大学为该论文通讯单位,药学院许康教授为该论文的通讯作者,检验学院王春莉副教授为该论文的共同一作/共同通讯作者,武汉协和医院董念国教授为该论文共同通讯作者。该成果的发表打破了学校发表论文影响因子的纪录,是迄今为止学校在医学领域发表的最高影响因子论文。该论文的发表,意味着我校在本土也能发出世界顶级期刊,是学校推动高质量发展建设成果的具体体现。

钙化性主动脉瓣病(CAVD)是一种常见的心血管疾病。到目前为止,还没有发现有效的药物能干预或减缓CAVD 的发病进展。一旦出现严重的CAVD症状,唯一有效的治疗方案是选择瓣膜置换手术。因此,探索有效的疾病靶点,可为抑制瓣膜钙化的药物研发提供依据。
尽管在前期的研究中,研究团队通过构建CAVD的单细胞测序图谱,对瓣膜钙化的病理进程进行了深入解析,但其主要调节因子和确切的分子机制仍然难以捉摸,控制瓣膜间质细胞(VICs)成骨转变的确切信号机制尚不清楚。在已有工作基础上,湖北时珍实验室、湖北中医药大学的许康教授团队联合国内多家单位,开展了为期4年、耗费80万元以上经费的科技攻关研究,通过对9个从年轻、老年到钙化患者的人主动脉瓣膜单细胞测序结果深度分析,科研团队成功解析了VIC病理转化的全过程,并鉴定出了lumican(LUM)这个分子在CAVD中的促钙化作用。
科研团队在许康教授、王春莉副教授的引领下,通过构建双敲除转基因小鼠,并从体内、体外、离体组织培养等四个维度证实了LUM的促钙化作用;进一步通过多组学分析,细胞分子生物学实验,验证了LUM通过介导糖酵解途径,促进H3组蛋白乳酸化修饰,产生促钙化的作用。这一“分子-代谢-表观修饰”的创新机制,为瓣膜钙化的病理过程提供了新的路径,为瓣膜钙化的治疗提供了新靶点。全文数据正图6幅,补充图19幅,表格7个,工作量大、创新性好。
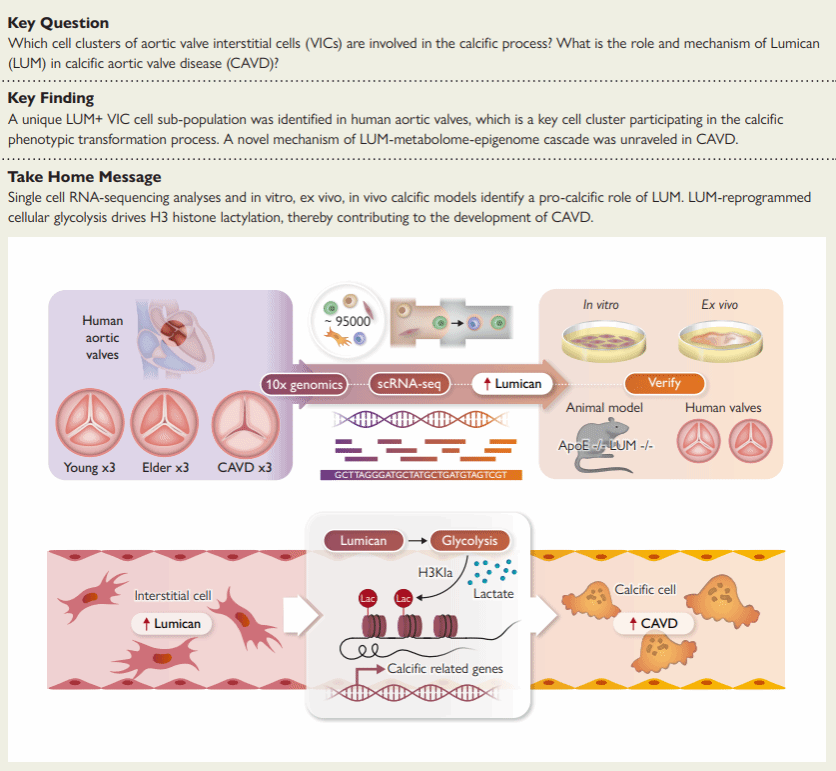
图文摘要(版权归Oxford University Press所有):单细胞RNA测序(scRNA-seq)描绘了瓣膜间质细胞(VIC)病理转化的过程,并强调了lumican(LUM)作为一种新分子在这一过程中的意义。在体外、离体和ApoE-/-//LUM-/-双敲除小鼠上证实了LUM的促钙化作用。LUM通过增强细胞糖酵解诱导VICs成骨病变,导致乳酸的积累。随后的多组学方法和分子生物学验证揭示了一种新的LUM驱动H3组蛋白乳酸化修饰,它在促进瓣膜钙化中发挥作用。